
Philipp DAVID – Consultant
Meine Kernkompetenzen liegen in der Beratung, Planung und Umsetzung von Qualitätsmanagement, Regulatory Affairs & Medizintechnik Projekten unter Einhaltung von nationalen und internationalen gesetzlichen Vorgaben.

Master of Science in Regulatory Affairs

Certified Medical Device Auditor
REGULATORY AFFAIRS MANAGEMENT
ERSTELLEN EINER
MDR | IVDR ROADMAP
GAP Analyse
Zweckbestimmung & Leistungsversprechen formulieren
Produkte klassifizieren
QM-System, UDI-System umsetzen
UMSETZEN GESETZLICHER VORGABEN
Erstellen der Produktakte nach MDR/IVDR, MPDG und nationale Verordnungen
Produkte einstufen nach MDR/IVDR Klassifizierungsregeln
Auswahl des Konformitätsbewertungsverfahrens
Umsetzen der Anforderungen an die klinische Bewertung nach MEDDEV 2.7/1 Revision 4
Post-Market Surveillance PMS implementieren
UMSETZEN DER GRUSULA
Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen durch harmonisierte Normen und dem Stand der Technik
ISO 13485 Medizinprodukte – Qualitätsmanagementsystem
ISO 14971 Anwendung des Risikomanagements
IEC 62304 Software-Lebenszyklusprozess
IEC 82304 Gesundheitssoftware
IEC 81001-5-1 IT-Sicherheit im Software-Lebenszyklus
IEC 62366-1 Anwendung der Gebrauchstauglichkeit
IEC 60601-1 Medizinische elektrische Geräte – Sicherheit und wesentliche Leistungsmerkmale
MEDIZINTECHNIK
ELEKTRIK | PNEUMATIK
Erstellen normativ erforderlicher Dokumente
- Funktionsschemas
- Blockschaltbilder
- Isolationsdiagramme
- Verkabelungs-, Pneumatik-, Hydraulikpläne
MECHANIK
Erstellen von CAD Konstruktionszeichnungen
- Prototypen-Zeichnungen
- Fertigungs-Zeichnungen
- Montage-Zeichnungen
SOFTWARE
Softwareentwicklung
- Aufnahme von Stakeholder Anforderungen
- Unterstützung bei der Softwareentwicklung
- Dokumentation nach geforderten Regularien
SICHERHEITSTECHNISCHE KONTROLLE STK
Dental- und Medizinprodukte müssen laut der MDR und MPBV wiederkehrend, zwischen 12 und 36 Monate überprüft werden.
Die Häufigkeit der Überprüfung richtet sich nach Geräteart und Herstellerangaben.
WARTUNG & REPARATUR
Die Geräte werden vor Ort unter Berücksichtigung Ihrer täglichen Abläufe gewartet und geprüft.
Wir unterstützen Sie mit Lösungsvorschlägen zur Behebung festgestellter Mängel.
Alle Reparaturen werden zeitnahe und unter Einhaltung aller normativen Anforderungen durchgeführt.
ÜBERPRÜFUNG NACH
IEC 62353
Medizinische elektrische Geräte
MDR
Medical Device Regulation
MPBV
Medizinproduktebetreiberverordnung
österreichische oder deutsche Fassung
KUNDEN
Zu meinen Kunden zählen unter anderem Hersteller von Dental- und Medizinprodukten, Physiotherapie Zentren und Zahnarztordinationen in Österreich und Deutschland.
AUSZUG REFERENZEN
ENTWICKLUNGS-PROJEKT
W&H Prüfgerät für Dentalmotore und Luftinstrumente
BERATUNG
Dentale Behandlungseinheit TM6+ der Firma Innodent
BERATUNG
Dentale Absaugung PowerSuc der Firma Innodent

- Erstellen einer Projekt Roadmap
- Dokumentation der Anforderungen
- Produktdesign
- Umsetzen technischer und gesetzlicher Vorgaben
- Serienüberleitung
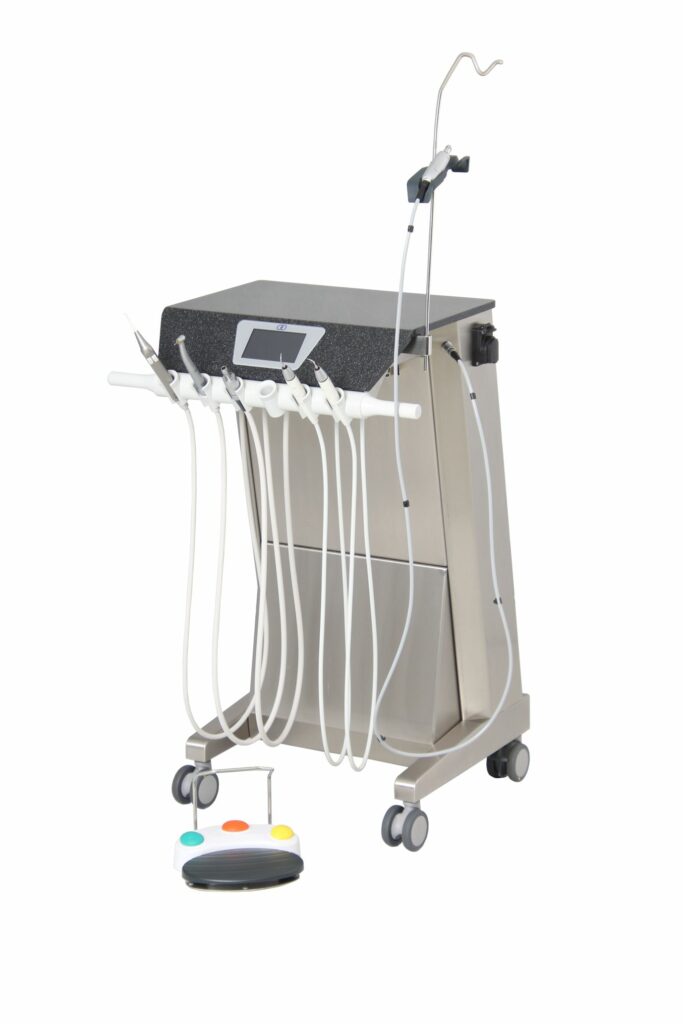
- Erstellen einer MDR Roadmap
- Umsetzen gesetzlicher Vorgaben
- Nachweis der GRUSULA
- Erstellen normativ erforderlicher Dokumente

- Erstellen einer MDR Roadmap
- Umsetzen gesetzlicher Vorgaben
- Nachweis der GRUSULA
- Erstellen normativ erforderlicher Dokumente
Mein Ziel ist nicht nur eine umfassende Beratung und Betreuung, sondern auch eine optimale Preisgestaltung.
KONTAKT
Sie erreichen uns telefonisch




